Jedním z častých problémů při Sangerově sekvenování jsou vzorky s vysokým obsahem solí. V obecné rovině by člověk mohl mluvit o inhibitorech jako takových, ale sole jsou asi nejčastější případ. Pokud nám takovéto vzorky zasíláte, pravděpodobně nebudete příliš spokojeni s kvalitou výsledku. V tomto článku se podíváme blíže na to, proč tomu tak je, a hlavně, co se s tím dá dělat.
Proč jsou sole problém
Sangerovo sekvenování není v zásadě nic jiného než enzymatická reakce plus elektroforéza. Reakce probíhá za použití komerčních mixů a případná iontová nerovnováha bude samozřejmě na její průběh mít negativní vliv.
Elektroforéza v automatických analyzátorech se pak provádí v kapilárách. Pokud jsou ve vzorku nežádoucí příměsi, pak samozřejmě záleží, jak se chovají v elektrickém poli. Ionty solí představují velký problém. Jedná se o nabité částice, takže se do kapilár dostanou, a jelikož jsou malé, migrují jimi velice rychle, podobně jako malé fragmenty DNA.
Případné sole v zaslaném templátu tedy mohou působit potíže v různých fázích jeho zpracování a může se to ve výsledku projevit různým způsobem.
Co se týká vlastní sekvenační reakce, tak v tomto kroku nelze na naší straně a při rutinním zpracování výsledek v podstatě nijak ovlivnit. Templát bereme tak, jak nám jej dodáte, tedy i zasolený, před reakcí jej nepřečišťujeme, takže případný inhibiční vliv neodstraníme. Následné zpracování produktů sekvenační reakce se provádí tak, aby se (mimo jiné) všechny sole odstranily před vlastní elektroforézou. To znamená, že po provedení sekvenační reakce musí být její produkty přečištěny a jeden z důvodů, proč se to dělá, je právě odsolení. Čistá DNA se následně rozpouští v nějaké deionizované matrici, z níž je „injikována“ do kapiláry.
Ideální stav je tedy ten, že sekvenační reakce se provádí na čisté DNA v nějaké reakční směsi, jež samozřejmě sole v malém množství obsahuje (jako součást reakčního pufru), ale tyto jsou následně odstraněny v kroku přečištění reakce. Získaný čistý produkt se z deionizované matrice dostává do kapilár a dochází k jeho velikostní separaci, jejímž výsledkem budou krásná data.
Co se stane, pokud je vzorek zasolený
Sole ve vzorku vidíme samozřejmě až po elektroforéze, dříve to není technicky možné. Typicky se sole v kapiláře projeví jako bílá plocha na počátku elektroferogramu, musíte se ovšem dívat hlavně na hrubá data. Vypadá to asi takto, nahoře zasolený vzorek, dole čistý, sole jsou ta bílá oblast na počátku hrubých dat (viz elipsa):
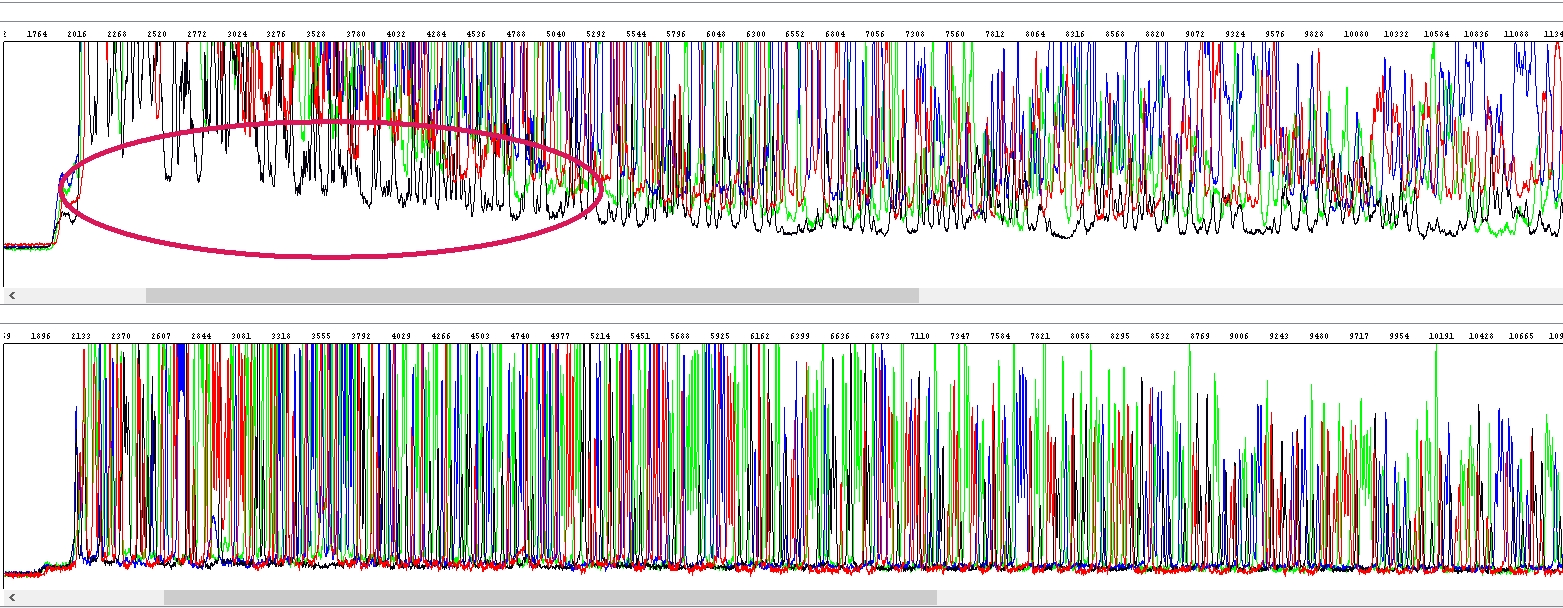
Povšimněte si zvýšeného pozadí právě v důsledku jejich přítomnosti. Podle obsahu solí může být tato „bílá plocha“ větší či menší a to má samozřejmě vliv na to, jak vypadají data v elektroferogramu:
Toto je příklad extrémně zasoleného vzorku! Na první pohled vypadá elektroferogram nahoře jako směs, ale příčina je jinde, ani přečištění sekvenační reakce sole neodstranilo.
Pokud od nás dostanete takovýto výsledek, nedá se s tím už dělat nic. Opakováním elektroforézy dostaneme tentýž obrázek. Vzorek by šel teoreticky přečistit znovu ve snaze ty sole odstranit, ale v praxi je každé přečištění spojeno se ztrátou DNA a rozhodně to nedoporučujeme a ani nenabízíme. Nestojí to upřímně řečeno za tu námahu. Je potřeba se z toho v prvé řadě poučit a pozměnit pracovní postup při přípravě templátů tak, aby k této situaci příště nedošlo. V tuto chvíli tedy přijde na řadu otázka, kde se tam ty sole vzaly a co mám změnit?
Odkud mohou sole pocházet?
Sekvenujeme v zásadě dva typy produktů, plazmidy a PCR produkty. Ideální stav je, že jsou oba typy templátů vždy vámi přečištěny (mimo jiné tedy odsoleny) a následně je na nich námi provedena sekvenační reakce. V praxi nicméně často dochází k tomu, že si klient práci usnadní anebo některé komerční soupravy nezafungují optimálně. Příkladem jsou třeba tzv. colony PCR. I když bude PCR reakce fungovat, reálně jsou po jejím provedení ve zkumavce různé kontaminace. Pokud nám takový vzorek následně zašlete, může být výsledek uspokojivý a také nemusí, opět v závislosti na obsahu kontaminujících látek. Jejich přítomnost může totiž inhibovat už samotný průběh sekvenační reakce (nemluvě o vlastní elektroforéze), takže její výtěžek bude mizerný a signály nízké navzdory tomu, že je samozřejmě každá sekvenační reakce námi vždy přečišťována.
I když takovýto PCR produkt přečistíte, nemusí ani to stačit. Některé způsoby přečišťování např. PCR produktů jsou totiž vhodnější než jiné a je vždy třeba mít na paměti, že co platí pro jednoho, nemusí platit pro druhého. Velmi dobrý a účinný způsob přečišťování PCR produktů je třeba ExoSAP. Je to jednoduchá a robustní metoda, která zajistí defosforylaci nukleotidů a degradaci primerů, ale nikdy neodstraní žádné sole ani jiné kontaminace. Máte-li tedy problém s vysokým obsahem solí v templátech pro vaši PCR, není přečištění PCR produktů ExoSAPem zrovna to nejlepší, co můžete zvolit, jakkoliv je to pro jiné PCR produkty metoda velmi vhodná.
Podobně třeba přečišťování na kolonkách se může změnit v noční můru, protože navzdory desítkám let vývoje kolonkových kitů jsou některé stále spíše pro zlost, viz starší článek zde.
V souhrnu se vyplatí znát princip různých dostupných postupů a nespoléhat se jenom na různé komerční návody k soupravám, jejichž složení navíc ve většině případů vůbec neznáte.
Jak mohou vypadat výsledky?
Pokud máte problém s obsahem solí ve vzorcích, mohou výsledky vypadat různě. Jeden příklad vidíte na obrázku výše a níže je několik dalších příkladů.
Příklad č. 1:
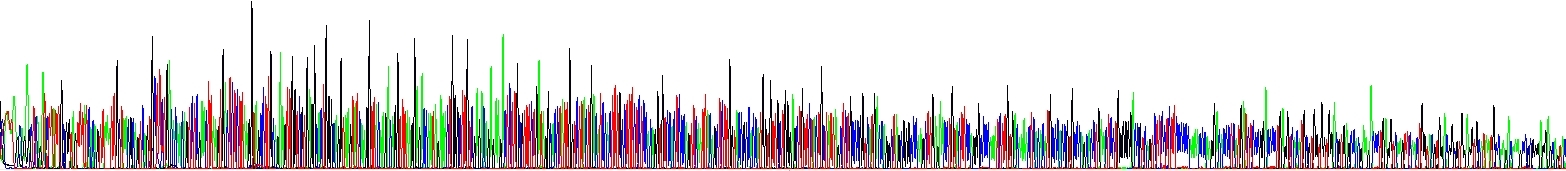
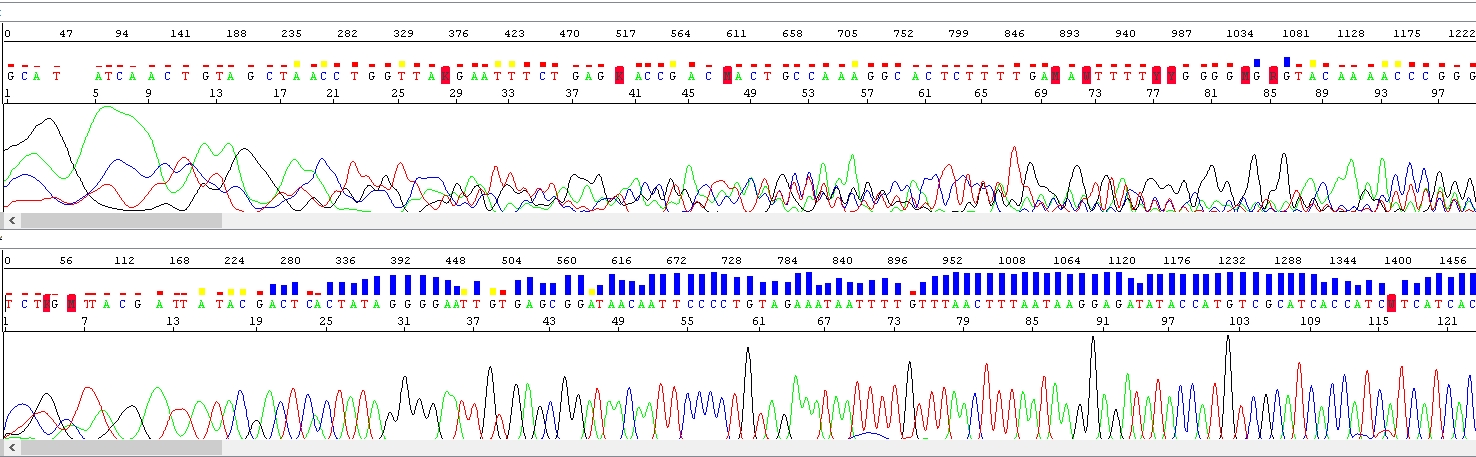
Správná koncentrace solí
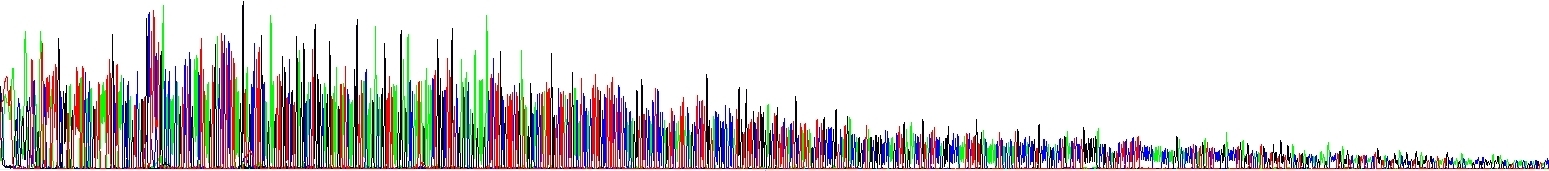
Sekvenační reakce byla provedena s totožným templátem a identickým způsobem, ale do druhého vzorku byl přidán NaCl. Množství solí ve vzorku je tedy zvýšené, ale pouze málo (srovnejte s obrázkem výše). Povšimněte si klesajícího signálu. Je to typický výsledek v případě, že koncentrace solí je zvýšená, ale stále ne příliš vysoká a nedochází ke kompletní inhibici sekvenační reakce. Současně se sole podařilo efektivně odstranit před samotnou elektroforézou, pozadí není zvýšeno.
Příklad č. 2:
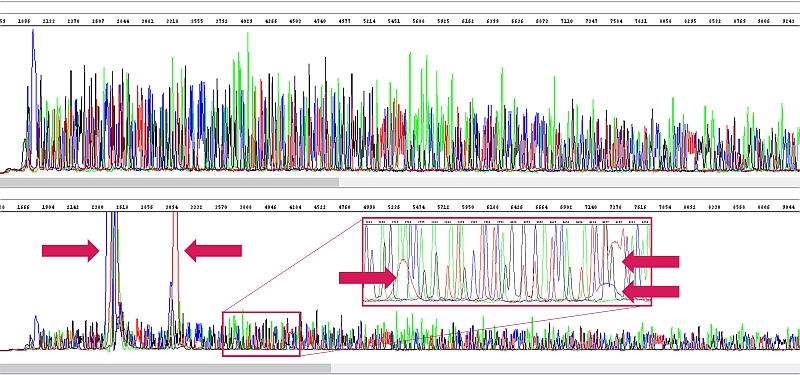
Ve vzorcích byl vysoký obsah nějakého inhibitoru (v tomto případě si bohužel nejsme jisti, že se skutečně jednalo o sole). V důsledku jeho přítomnosti došlo nejenom ke snížení intenzity signálu a tedy i délky čtení, ale v reakci se vyskytly i tzv. bloby (viz šipky), které problematizují interpretaci sekvenačních dat všude, kde se vyskytují. Jelikož koncentrace DNA v těchto vzorcích byla dobrá, vzorky jsme na žádost klienta třikrát naředili a reakci opakovali (ředit se pochopitelně musí templát do sekvenační reakce, nikoliv produkt do kapiláry). Tento výsledek je již v pořádku (nahoře opakovaná sekvenační reakce po naředění templátu, dole původní vzorek s bloby).
Poznámka k blobům - Tzv. bloby jsou zbytkové barevné terminátory. Reálně dojde k tomu, že koncentrace DNA je buď nízká anebo dobrá, ale jsou současně přítomny inhibitory. Sekvenační reakce tedy probíhá s nízkým výtěžkem, čemuž odpovídá nízká spotřeba terminátorů. Při následném přečištění sekvenační reakce se nepodaří veškeré tyto volné terminátory odstranit a vidíte je v elektroferogramu. Jsou to tedy všechno spojené nádoby: málo DNA nebo inhibice = nízký výtěžek reakce = nízký signál v elektroferogramu a někdy bloby = většinou krátká délka čtení a horší čtení na počátku (kvůli solím) a v oblasti blobů. Je-li tedy příčinou tohoto stavu málo DNA v reakci, musí se přidat příště víc. Je-li ale příčinou tohoto stavu kontaminace DNA a tudíž inhibice sekvenační reakce, může situaci pomoci dát DNA méně (nikoliv málo) a nebo se musí lépe přečistit.
Příklad č. 3:
Někdy bývá situace složitější. Pokud se například vyskytnou ve vzorcích kontaminace (sole) v kombinaci s nějakým dalším problémem, může být výsledek matoucí a interpretace problematická, zejména pokud s ní nemáte dost zkušeností. Níže je ukázka špatně přečištěného a navíc směsného vzorku:
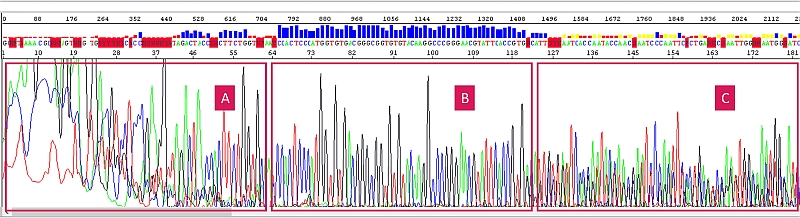
A – sekvence je hůře čitelná kvůli zasolení, B – sekvence je v pořádku, sole už migrovaly pryč, C – sekvence je bez solí ale směsná (směsný templát).
Do hry samozřejmě mohou vstupovat další faktory jako je intenzita signálu apod. Možností, jak mohou vypadat výsledky, je tedy zkrátka mnoho. Výše uvedené příklady berte jako ilustrativní, nikoliv jako kompletní výčet možností.
Krátké shrnutí
V kostce lze poněkud nepřekvapivě říci, že chcete-li mít dobré výsledky, musíte dodávat čistou DNA. Pokud vaše výsledky vypadají jako na obrázcích výše, je zapotřebí analyzovat, proč tomu tak je a zvolit odpovídající nápravné kroky, k čemuž doufejme trochu dopomůže i tento článek. Na naší straně není bohužel vzhledem k rutinnímu charakteru práce téměř žádný prostor k optimalizaci. Teoreticky bychom mohli vzorky např. vyřeďovat apod., ale v praxi to vždy znamená zpoplatněné opakování analýzy.
Mějte na paměti, že:
Upozorňujeme závěrem, že veškerá doporučení je nutno brát jako orientační a vždy je nutné správně zhodnotit vaši konkrétní situaci. V případě dotazů nás neváhejte kontaktovat.
Pozn.: Nedávno jsme rovněž publikovali článek, popisující porovnání různých přečišťovacích souprav. Je dost dobře možné, že nízká kvalita výsledku některých z nich (a např. krátká délka čtení) je do určité míry (případně výhradně) způsobena inhibitory obsaženými v produktu čištění.
Sanger lab, info@seqme.eu